通过亲电反应可以在烯烃、炔烃、芳烃底物上温和、高效地引入单个或多个官能团,快速实现底物的官能团化,为分子的构建提供一条理想的途径。鉴于这类反应的合成优势,发展不对称亲电反应已然成为重要的研究领域。然而,由于亲电物种反应性、手性中间体消旋化以及手性催化剂骨架限制的问题,该领域存在诸如底物、亲电和亲核试剂范围以及反应类型等的局
限性。
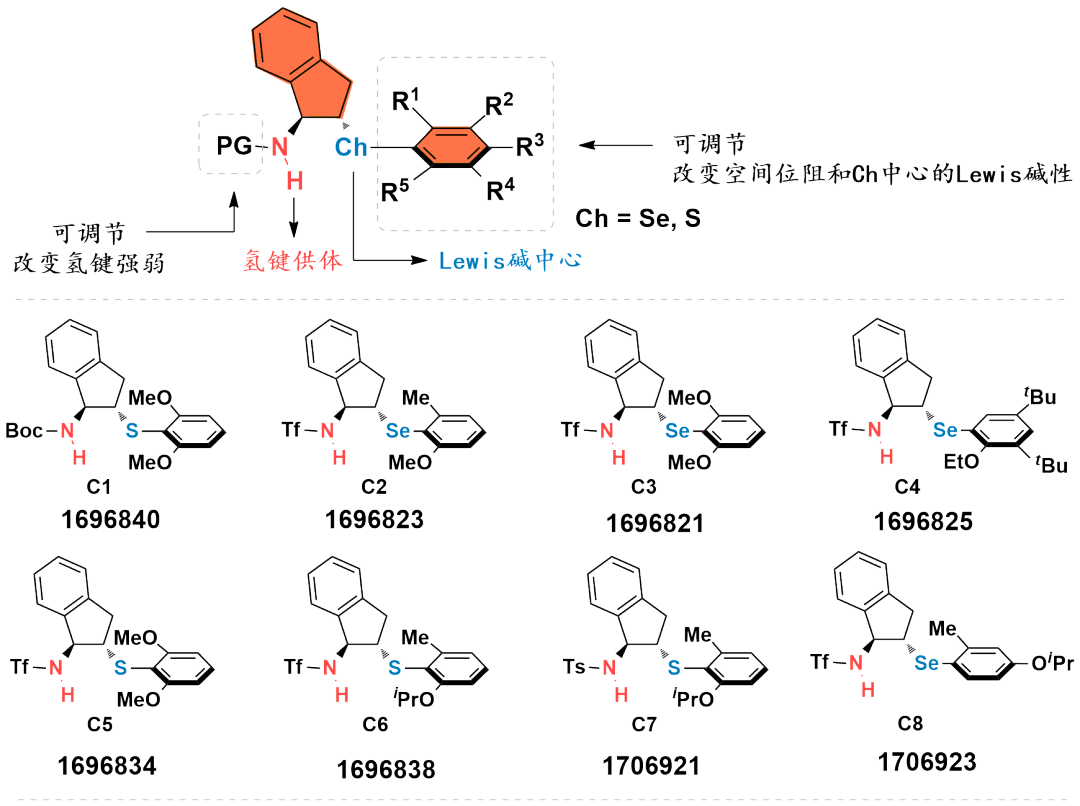
图1
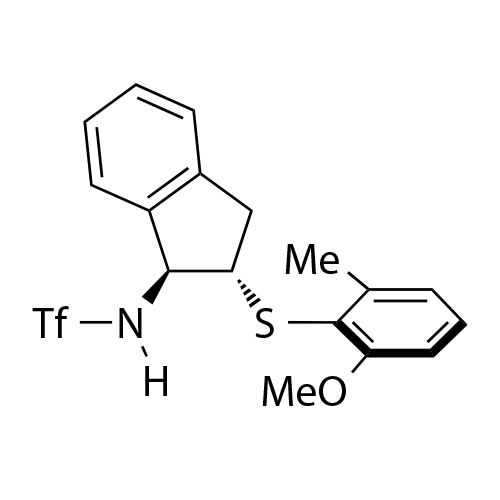
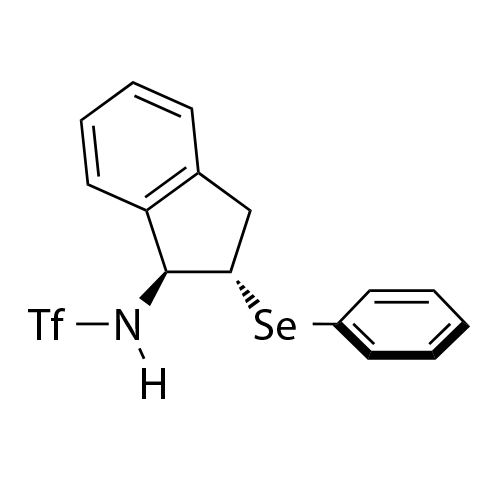
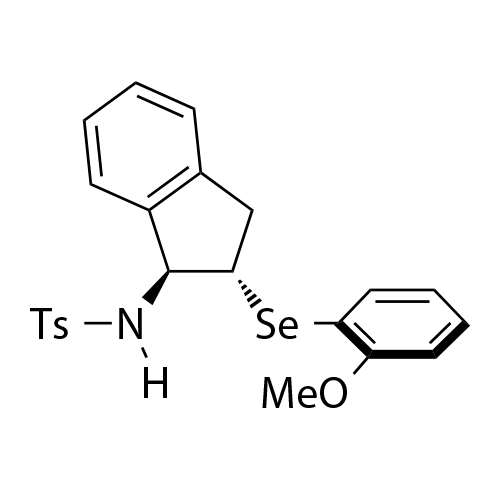
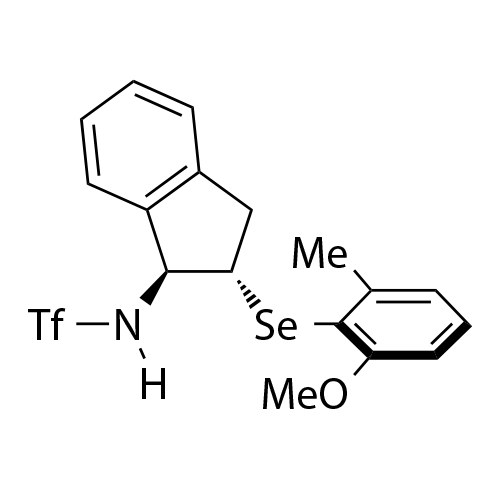
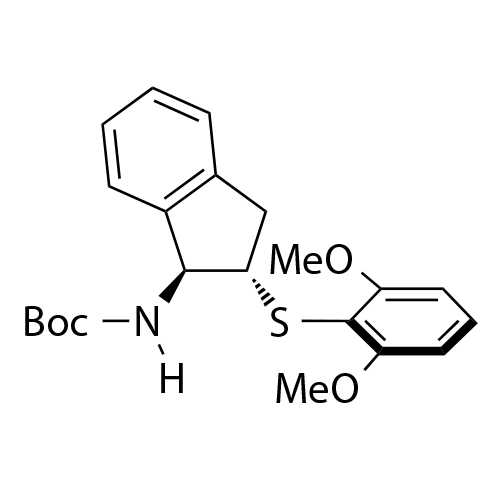
基于茚满骨架的双官能手性Lewis碱性芳基硫属化合物催化剂
为了克服其局限性,
中山大学赵晓丹教授课题组开发了一类基于茚满骨架的双官能手性Lewis碱性芳基硫属化合物催化剂
。该类催化剂应用在不对称亲电反应中起到优良效果。代表性的催化剂如图1所示。该类催化剂容易调节,例如:(1)可通过改变催化剂中的氨基保护基为不同的反应提供合适的氢键供体;(2)可通过在芳基上引入不同的取代基来灵活调控催化剂的空间位阻及硒/硫原子的Lewis碱性,从而改善反应的反应性和对映选择性。除此之外,该类催化剂的茚满骨架上的胺基和芳硒/芳硫基处于五元环的上下两侧能够形成良好的手性口袋,适应不同的底物。得益于这些有利条件,利用这类新型催化剂实现了亲电三氟甲硫基试剂、亲电长链烷硫基试剂、亲电芳硫基试剂、亲电氯化试剂、亲电溴化试剂、
亲电碘化试剂在特定条件下的活化,进而完成了烯烃、炔烃、芳烃等不饱和化合物的不对称亲电官能团化,高效构建了一系列具有碳中心手性、磷中心手性、轴手性的手性分子
(Acc.Chem.Res.202
2,55,2439)
该研究团队开发的手性催化剂应用在不对称亲电反应领域的代表性的研究成果如下:
2016年,该研究团队将茚满骨架的双官能手性硫醚C1作为催化剂,应用在烯酸的不对称三氟甲硫基化内酯化反应中获得好的效果,如图2所示
(Angew.Chem.Int.Ed.2016,55,5846)。产物的对映选择性能够达到91%
ee。该研究工作对不对称三氟甲硫基化反应方面的研究具有启发意义。
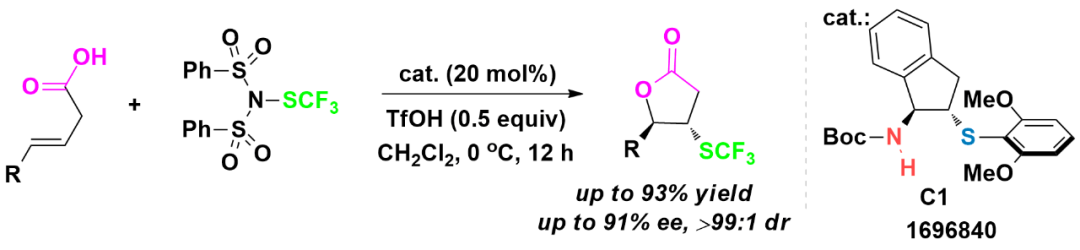
图2 烯酸不对称三氟甲硫基化内酯化反应
随后,利用含有邻位甲基和甲氧基的手性硒醚C2作为催化剂时,能够实现烯烃不对称的三氟甲硫基化胺环化反应,产物的产率高,对
应和非对应选择性优秀(org.lett.2017,19,3434),也能够实现烯基同碳二芳烃不对称的去对称化和三氟甲硫基化碳环化反应,反应效果优良,利用该方法能够高效构建全碳或者季碳手性中心,为手性四氢化萘衍生物的合成提供了一条新的思路(Nat.Commun.2018,9,527)。利用该催化剂,还可以实现三取代烯烃的不对称烯丙基三氟甲硫基化和分子间的不对称双官能团化反应,反应的官能团兼容性好、产率优良、对应和非对应选择性好(J.Am.
Chem.Soc.2018,140,4782)。如图3所示。
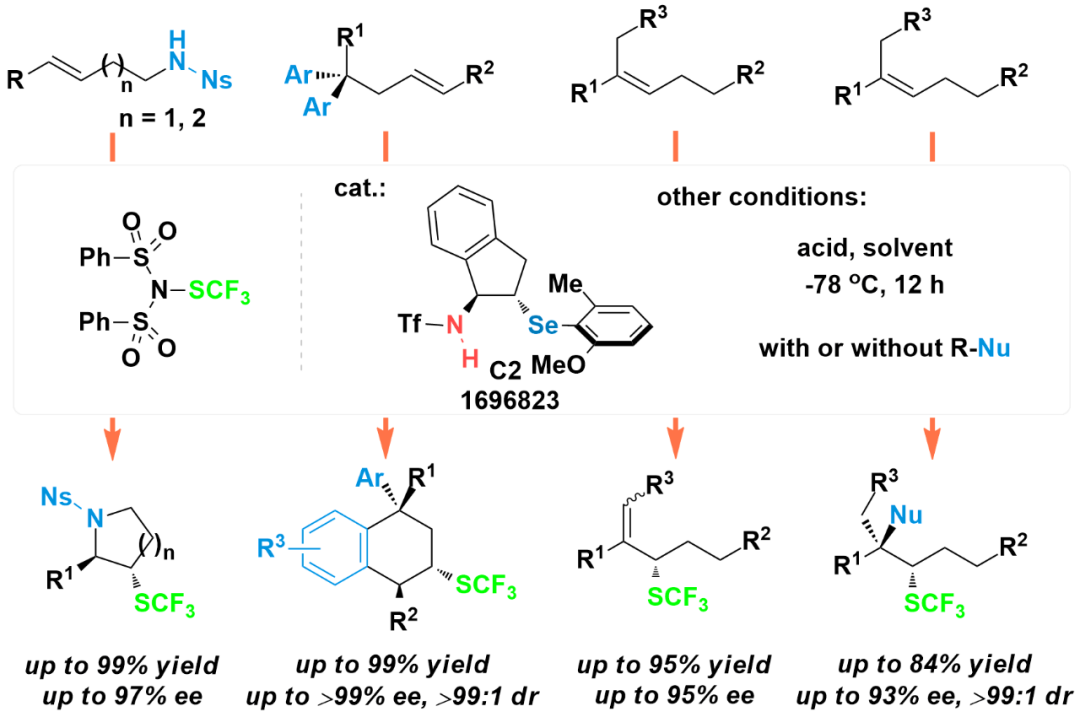
图3
烯烃不对称三氟甲硫基化胺环化、碳环化以及烯烃不对称烯丙基三氟甲硫基化和分子间双官能团化反应
这类催化剂还可以应用到1,2-取代烯烃分子间的不对称双官能反应中。
例如采用双官能的手性硒醚C4作为催化剂,烯丙基磺酰胺作为底物,亲电的烷基硫化试剂或者芳基硫化试剂作为第三组分,能够高效实现硫基化叠氮化、硫基化羟基化和硫基化醚化反应,反应的产率高,对映和非对映选择性优良(ACS
Catal.2019,9,6896)。当利用酚或者富电子的芳香烃类化合物作为亲核试剂时,反应也能够顺利进行,生成芳基化的手性产物(ACS
Catal.2021,11,3755)。值得一提的是,采用硅氢试剂作为亲核试剂时,反应同样能够高效发生,生成手性的硫醚产率高,对应选择性优秀(Org.Lett.2022,24,7210)。如图4所示。
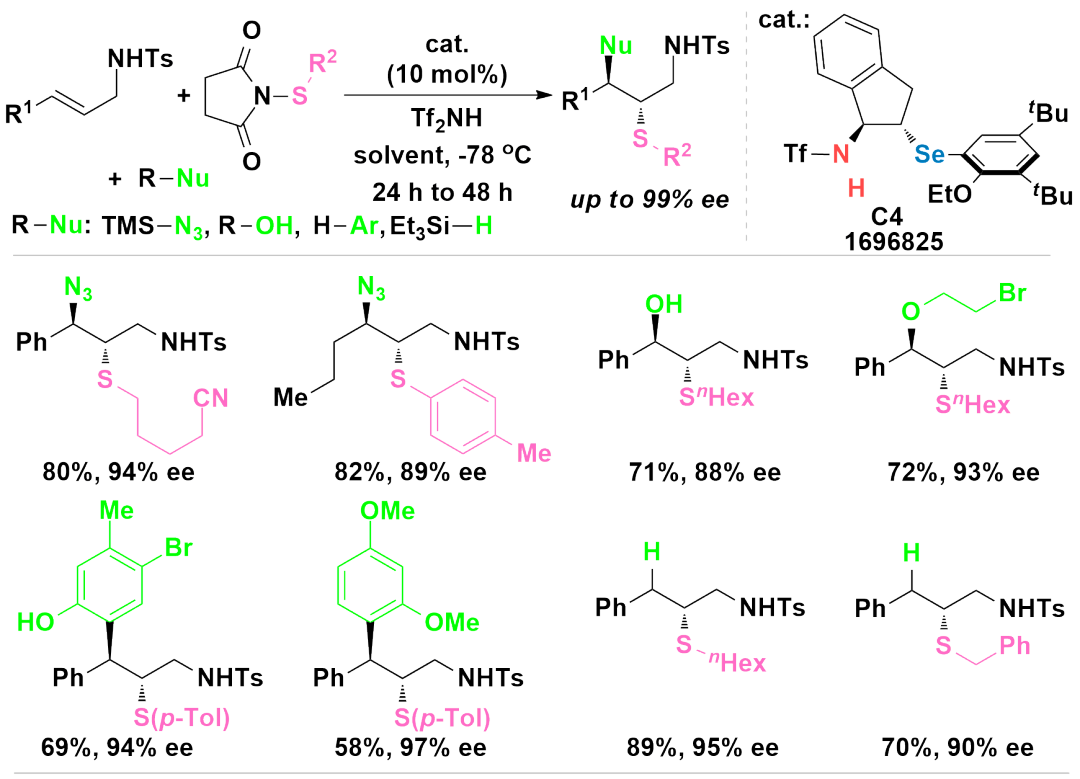
图4 烯丙基磺酰胺分子间的不对称双官能团化反应
另外,利用手性硫醚C7作为催化剂,邻位炔基苯胺类化合物作为底物时,通过不对称亲电硫化反应,能够制备一类官能团化的烯烃─芳基联萘衍生物类的轴手性化合物(Angew.Chem.Int
Ed.2020,59,4959)。如图5所示。这类2-胺基-2′-硫轴手性化合物因其有独特的化学结构和含有可转化的基团,可以作为平台分子,通过简单的转化,生成有价值的配体和具有潜在应用价值的轴手性化合物。
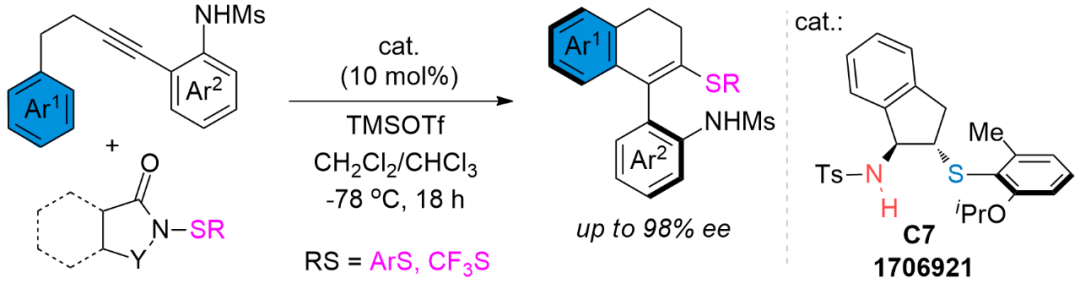
图5 炔烃不对称亲电硫化反应构建轴手性化合物
亲电卤化是快速构建手性含卤分子的一种重要途径,通过亲电卤化反应能够构建其他方法不能制备的化合物。由于氯原子是一种好的转化基团,且广泛存在于生物活性分子和天然产物中,发展亲电的氯化方法受到关注。研究中发现,利用双官能的手性硫醚C5作为催化剂时,能够实现烯烃不对称去对称化的亲电氯化碳环化反应,构建了一系列的含季碳手性中心的四氢化萘衍生物,反应的产率优良,对映选择性达到99%ee,非对映选择性达到20:1dr(Angew.Chem.Int.Ed.2019,58,1315)。如图6所示。

图6 烯烃不对称去对称化和亲电氯化反应
利用双官能的手性硒醚C8作为催化剂,通过去对称化和芳烃的亲电氯化反应,能够含磷手性中心的化合物,同样地,反应的产率优良,对映选择性能够达到99%ee(CCSChem.Chem.2020,2,2617)。如图7所示。
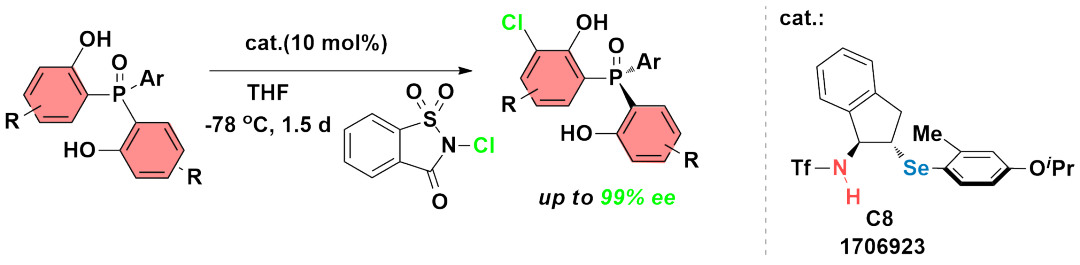
图7
通过芳烃的亲电氯化和去对称化构建含磷手性中心
另外,利用双官能的手性硫醚C6作为催化剂时,能够实现烯丙基磺酰胺的分子间不对称亲电碘化双官能团化反应,高对映选择性地构建了一系列碘化手性分子。反应中,不同的酚、醇、叠氮化合物和含氟试剂均可以作为亲核试剂。如图8所示。反应的底物宽泛,官能团的兼容性好。值得一提的是,所得的碘化产物可通过重排或取代反应转化为高价值的α-芳基酮、手性二级胺、氮杂环丙烷等手性分子(J.Am.Chem.Soc.2022,144,16490)。

图8
烯丙基磺酰胺的分子间不对称亲电碘化双官能团化反应
赵晓丹教授,博士生导师
赵晓丹,中山大学化学学院教授,博士生导师。2002年湖北大学本科毕业。2007年,中国科学院大连化学物理研究所博士毕业,博士生导师为余正坤研究员。研究生期间,第一年在中国科技大学学习基础课程,2005年作为交换学生在加拿大渥太华大学学习和研究近一年。2008年至2013年分别在加拿大多伦多大学(合作导师Vy
M.Dong教授)和美国科罗拉多大学(合作导师Tomislav
Rovis)从事博士后研究。2013年6月入职中山大学化学学院并独立开展研究工作。主要研究兴趣包括不对称合成、有机硫属化合物催化、有机硒化学。发展了一类基于茚满骨架的双官能硫属化合物催化剂,应用在不对称亲电反应中获得优良效果。目前,在国际重要学术期刊Acc.Chem.Res.J.
Am.Chem.Soc.Angew.Chem.Int.Ed.CCS
Chem、Nat.
Commun.ACS
Catal.等发表学术文章多篇。






 400-821-0725
400-821-0725













 沪ICP备17019645号
沪ICP备17019645号









